 中学1年生の理科では、「身の回りの物質-状態変化」という単元を学習します。
そこでこの記事では、この単元が苦手という中学生やそして中学生に勉強を教える親御さんのために抑えておくべき重要なポイントをわかりやすくまとめたので参考にしてください。
中学1年生の理科では、「身の回りの物質-状態変化」という単元を学習します。
そこでこの記事では、この単元が苦手という中学生やそして中学生に勉強を教える親御さんのために抑えておくべき重要なポイントをわかりやすくまとめたので参考にしてください。
状態変化とは
 状態変化とは一言でいうと、ある物質が温度によって固体・液体・気体の状態に変化することを指します。
それぞれのフェーズに行く時のプロセスには次のようにそれぞれ名前がついていて、状態変化の呼び名は以下の通りです。
状態変化とは一言でいうと、ある物質が温度によって固体・液体・気体の状態に変化することを指します。
それぞれのフェーズに行く時のプロセスには次のようにそれぞれ名前がついていて、状態変化の呼び名は以下の通りです。
- 固体から液体 融解(ゆうかい)
- 液体から固体 凝固(ぎょうこ)
- 液体から気体 蒸発(じょうはつ)
- 気体から液体 凝縮(ぎょうしゅく)
- 気体から固体 昇華(しょうか)
- 固体から気体 昇華(しょうか)
状態変化とは何が変化している?
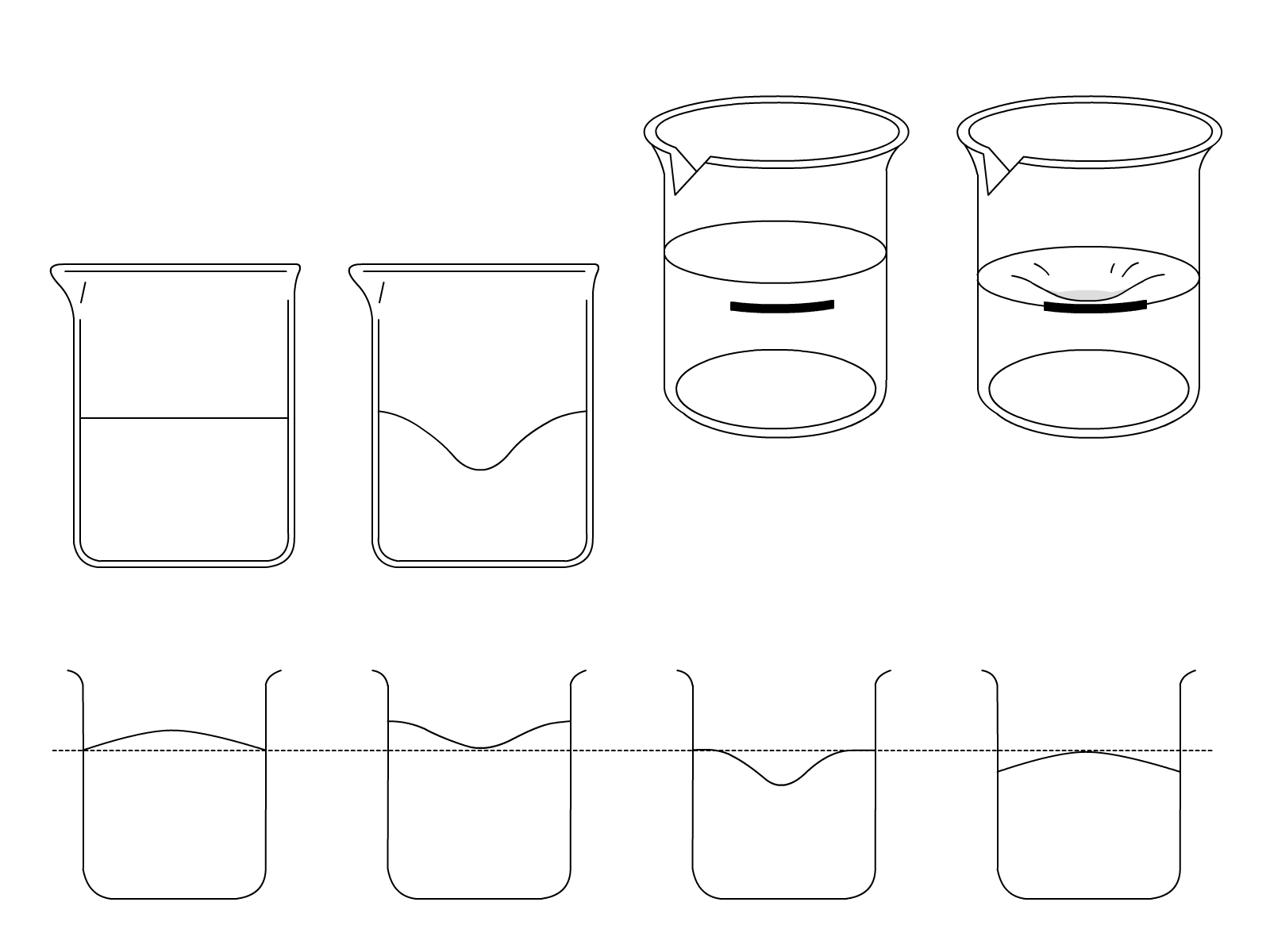
あと、状態変化について覚えておきたいことは、何が変化して、何が変わらないのかという点です。 状態変化では、体積は変化し、質量は変化しません。 たいていの物質の場合、固体の体積が一番小さくて、その次に液体の体積、一番気体の体積が大きくなります。 しかし、水の状態変化は例外なので気をつけましょう。 不等号で表すと、以下の通りです。固体の体積<液体の体積<気体の体積
なぜ体積が変わるのか、ある物質がたくさんの粒子の塊でできていると仮定して考える方法があります。 粒子たちには、熱を加えると、動きが活発になるっていう性質があり、一番温度が低い固体の時は、粒子たちは活発じゃないから、縮こまるため、体積が低いです。 温度が上がって粒子の動きが活発になってくると、粒子たちの活動範囲が大きくなるため、ゆえに、粒子が活発になって液体になった時には、物質全体の体積は大きくなるということです。 さらに、温度を上げて気体にすると、粒子たちが動き回る範囲が広がってるから、気体の体積は広がってるということになります。水の状態変化を見てみよう
 水の状態変化の場合は、それぞれ、
水の状態変化の場合は、それぞれ、
- 固体…氷
- 液体…水
- 気体…水蒸気
蒸留とは
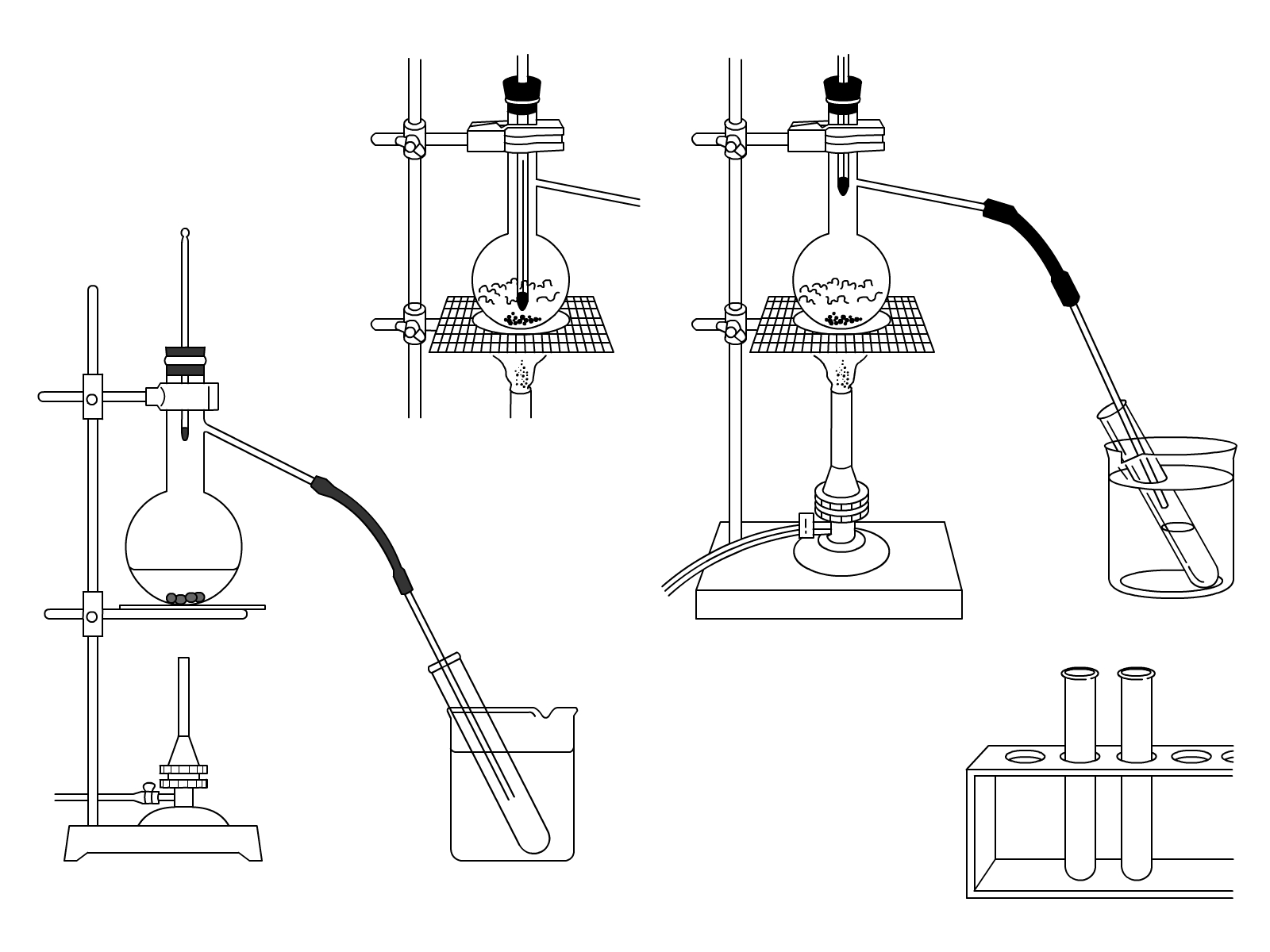 蒸留とは、ある「液体」の物質を「気体」にして「液体」にもう一回戻して取り出すことです。
たとえば、25℃の水を蒸留で取り出す場合を考えてみましょう。
まず、水を熱して、100度まで持っていく。すると、水が水蒸気になるから、この水蒸気を取りこぼさないように確保。この水蒸気をもう一回冷やすことで、水に戻して、水自体を手に入れること、これが蒸留です。
ただ、蒸留の真価が問われるのは、色々混ざっている液体から、ある特定の液体を取り出したいときです。
蒸留は物質の種類によって沸点が異なることを利用するもので、いろいろな物質が混じっている液体を熱してみる。
すると、沸点が低い物質は、他の物質よりも先に気体になります。つまり、その時点で気体になっているのはこの沸点の低い物質です。
この気体を冷やして液体にしてみると、純度100%の液体が取り出せるという方法になります。
たとえば、水とエタノールが混じった液体を熱した場合、エタノールの方が水よりも沸点が低いから、まずはエタノールの方が気体になります。
この出てきた気体を冷やすと、水が混ざっていないエタノールを100%の純度で取り出すことができます。
蒸留とは、ある「液体」の物質を「気体」にして「液体」にもう一回戻して取り出すことです。
たとえば、25℃の水を蒸留で取り出す場合を考えてみましょう。
まず、水を熱して、100度まで持っていく。すると、水が水蒸気になるから、この水蒸気を取りこぼさないように確保。この水蒸気をもう一回冷やすことで、水に戻して、水自体を手に入れること、これが蒸留です。
ただ、蒸留の真価が問われるのは、色々混ざっている液体から、ある特定の液体を取り出したいときです。
蒸留は物質の種類によって沸点が異なることを利用するもので、いろいろな物質が混じっている液体を熱してみる。
すると、沸点が低い物質は、他の物質よりも先に気体になります。つまり、その時点で気体になっているのはこの沸点の低い物質です。
この気体を冷やして液体にしてみると、純度100%の液体が取り出せるという方法になります。
たとえば、水とエタノールが混じった液体を熱した場合、エタノールの方が水よりも沸点が低いから、まずはエタノールの方が気体になります。
この出てきた気体を冷やすと、水が混ざっていないエタノールを100%の純度で取り出すことができます。
沸点と融点の違いをみよう
 沸点と融点の違いとはなんでしょうか。
それぞれ見ていきましょう。
沸点と融点の違いとはなんでしょうか。
それぞれ見ていきましょう。



